植物主要依赖其天然免疫系统抵御病原微生物的入侵。位于植物细胞膜的模式识别受体FLS2识别到细菌鞭毛蛋白保守的肽段flg22后与共受体激酶BAK1结合并相互磷酸化,并激活下游的胞质类受体激酶BIK1。激活的BIK1可以介导活性氧(ROS)的产生、钙离子进入胞质和气孔关闭等免疫反应。
为了防止过度的免疫反应对植物细胞本身造成伤害,BIK1丰度受到一个调节模块的精确调节。这个调节模块中钙依赖蛋白激酶28 (CPK28)对BIK1丰度起负调控作用。之前,刘晓彤副研究员和博士生周园园发现,CPK28会被两个E3泛素连接酶ATL31/6介导发生泛素化修饰,导致其被蛋白酶体降解(Liu et al., Plant Cell, 2022)。而在植物免疫激活过程中CPK28会发生分子间自磷酸化和BIK1介导的磷酸化,但CPK28的磷酸化状态是否决定其泛素化修饰和降解尚不清楚。
中国科学院遗传发育所农业资源研究中心作物设计育种大团队的研究人员发现,CPK28的Ser318位点(分子间自磷酸化和BIK1介导的磷酸化位点)或T76位点(BIK1介导的磷酸化位点)的突变会导致其与ATL31的互做减弱,并减少ATL31对CPK28的泛素化修饰,从而导致CPK28的降解减弱;此外,该研究证实了两个CPK28分子之间可以相互作用,这可能会促进分子间的自磷酸化;而CPK28的磷酸化状态反过来会影响CPK28分子间的相互作用。综上所述,CPK28的磷酸化状态会影响ATL31介导的CPK28蛋白降解。该研究揭示了CPK28磷酸化修饰与其泛素化修饰和降解之间的联系,进一步揭示了植物免疫的激活机制。
该研究结果以“Phosphorylation status of CPK28 affects its ubiquitination and protein stability”为题于2022年11月4日在线发表于New Phytologist杂志,刘晓彤副研究员为论文第一作者,博士研究生周园园为共同第一作者。该研究得到了国家自然科学基金委(31800222,32070555)、河北省自然科学基金委(C2019503069)和植物基因组学国家重点实验室的资助。
论文链接:https://nph.onlinelibrary.wiley.com/doi/abs/10.1111/nph.18596
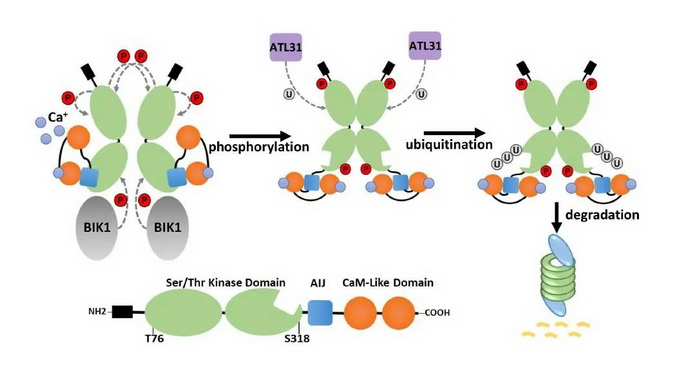
CPK28磷酸化状态决定其泛素化修饰和蛋白稳定性